ЕВОЛЮЦІЯ ФАРМАЦЕВТИЧНИХ СТРАТЕГІЙ ЛІКУВАННЯ ТА ПРОФІЛАКТИКИ COVID‑19






Контакти: rakhimovamv@nuph.edu.ua
У статті представлено комплексний науковий аналіз епідеміологічної ситуації та еволюції стратегій фармакотерапії COVID-19 станом на початок 2026 року. Досліджено етіологічні особливості нових субваріантів вірусу SARS-CoV-2 (ліній Stratus, Nimbus та Omicron) і верифіковано патогенетичні механізми їхньої інвазії, зокрема системний ендотеліїт та нейротропну активність. Здійснено систематизацію актуальних терапевтичних протоколів, що базуються на фазовості інфекційного процесу. Особливу увагу зосереджено на молекулярних механізмах дії препаратів, верифікації їхньої клінічної ефективності з позицій доказової медицини та оцінці потенційних фармакологічних ризиків. Деталізовано клініко-фармакологічні аспекти застосування етіотропних засобів прямої дії (нірматрелвіру/ритонавіру, ремдесивіру, молнупіравіру), таргетних імуномодуляторів (інгібіторів IL-6 та JAK) та антикоагулянтної підтримки. Особливу увагу приділено менеджменту постковідного синдрому (Long COVID) як пріоритетному напрямку охорони здоров’я у 2026 році. Обґрунтовано патогенетичну доцільність застосування нейропротекторних агентів (цитиколіну, вітамінів групи B), ангіопротекторів (L-аргініну, кверцетину) та засобів відновлення глікокаліксу для нівелювання когнітивного дефіциту та судинних ангіопатій. Визначено перспективні вектори фармацевтичних розробок, доведено необхідність адаптивної вакцинації та безперервного моніторингу доказової бази для оптимізації клінічних результатів.
Пандемія COVID-19, що викликана коронавірусом SARS-CoV-2, є безпрецедентною за масштабами надзвичайною ситуацією у сфері глобальної охорони здоров'я [1, 2]. Критичний вплив пандемії зумовлений синергією специфічних біологічних властивостей патогену та високим ступенем глобальної інтеграції соціуму. Інтенсифікація транскордонного сполучення та авіаперевезень сприяла лавиноподібному розповсюдженню вірусу в загальносвітовому масштабі у мінімальні часові проміжки. Наявність значної кількості вірусоносіїв із латентною формою інфекції нівелювала ефективність традиційних методів санітарного контролю (зокрема термометрії), що ускладнило ідентифікацію джерел інфекції та переривання ланцюгів передачі [2, 7].
Критичне навантаження на медичну інфраструктуру, а саме, масовий попит на інтенсивну терапію та респіраторну підтримку, спричинив дефіцит ресурсів у національних системах охорони здоров'я різних країн [2, 8]. Впровадження жорстких обмежувальних заходів (локдаунів) з метою стримування вірусної експансії зумовило масштабну рецесію світової економіки, порівнянну з глобальними кризами середини ХХ століття. Неконтрольоване поширення недостовірної інформації створило додаткові бар’єри для реалізації програм імунізації та дотримання протиепідемічного режиму [3].
Попри завершення гострої фази пандемії, станом на січень 2026 року вірус SARS-CoV-2 інтегрувався у структуру сезонної респіраторної захворюваності [4, 5]. Це вимагає від фармацевтичної спільноти розробки гнучких терапевтичних моделей, що відповідають принципам персоналізованої медицини та актуальним епідеміологічним викликам. Тому станом на 2026 рік систематичний моніторинг та оновлення фармакотерапевтичних протоколів лікування COVID-19 залишаються пріоритетним напрямком досліджень [2, 6, 9].
Необхідність подальшого безперервного вивчення та актуалізації фармацевтичних стратегій у 2026 році зумовлена низкою об'єктивних чинників.
Одним із таких чинників є висока швидкість антигенної еволюції SARS-CoV-2. Збудник COVID-19, вірус SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus 2), ідентифікується як одноланцюговий позитивний РНК-вмісний вірус, що належить до роду Betacoronavirus родини Coronaviridae [1, 2]. Морфологічно віріон характеризується сферичною структурою, оточеною ліпідною оболонкою з глікопротеїновими виступами («шипами»). Протеом вірусу включає чотири ключові структурні білки: S (spike) — ключовий поверхневий антиген, відповідальний за розпізнавання рецепторів та інвазію; E (envelope) та M (membrane) — протеїни, що формують вірусну оболонку та забезпечують збірку віріонів; N (nucleocapsid) — білок, асоційований із вірусним геномом у складі рибонуклеопротеїнового комплексу.
Персистенція та мутагенез вірусу призвели до появи нових варіантів, зокрема, ліній Stratus (XFG) , Nimbus та Omicron. Станом на 2026 рік еволюція SARS-CoV-2 характеризується домінуванням лінії Omicron (зокрема субваріантів зі значним мутаційним навантаженням у S-білку) [5, 9]. Сучасні штами демонструють виражений феномен «імунного вислизання», що знижує нейтралізуючу здатність антитіл, індукованих попередніми штамами або вакцинацією [3, 8]. Клінічно це супроводжується зниженням тропності до паренхіми легень порівняно з варіантами Alpha та Delta, що зумовлює переважно ураження верхніх дихальних шляхів [2, 7]. Поява нових мутацій вірусу зумовлює зниження терапевтичної ефективності раніше валідованих схем лікування, що потребує оперативного перегляду клінічних протоколів [6, 12].
В епідсезоні 2025/2026 спостерігається стабілізація епідемічного процесу COVID-19 в Україні з виразною тенденцією до сезонної циклічності [4]. За верифікованими даними Міністерства охорони здоров'я України, щотижневий рівень захворюваності на ГРВІ обчислюється десятками тисяч випадків, де SARS-CoV-2 утримує значну питому вагу [5]. Найвища інтенсивність поширення патогену (локальні спалахи) зафіксована у мегаполісах, зокрема у Київському регіоні, що корелює з високою щільністю популяції та інтенсивністю соціальних комунікацій.
Геномний нагляд станом на січень 2026 року підтверджує присутність нових антигенних варіантів у семи областях України, що відповідає глобальним трендам, зафіксованим World Health Organization [2]. Попри скорочення стратегій масового тестування, світові моніторингові системи постійно реєструють нові випадки інфікування, що підтверджує персистенцію вірусу в людській популяції [3, 8]. Найбільша загроза зберігається для детермінованих груп ризику (пацієнти віком 75+ та особи з коморбідною патологією), а також через зростання поширеності постковідного синдрому (Long COVID) [1].
Пріоритетним напрямком сучасної фармакотерапії наразі є застосування засобів із підтвердженим профілем ефективності (верифікація доказової бази противірусних агентів) [7]. Препарати прямої противірусної дії (зокрема ремдесивір та молнупіравір) залишаються базисними у терапії пацієнтів груп високого ризику, забезпечуючи зниження частоти госпіталізацій (згідно з даними клінічних спостережень — до 50%) [6, 9].
Комплексний огляд наукових джерел та клінічних протоколів станом на початок 2026 року дозволив структурувати лікарські засоби за наступними категоріями [2, 7, 8]:
Метою проведення даного дослідження є систематичний огляд та критичний аналіз актуальної номенклатури лікарських засобів, що застосовуються в клінічній практиці для терапії COVID-19 станом на 2026 рік.
Станом на січень 2026 року в клінічній практиці утвердився перехід від емпіричних схем лікування до стандартизованих протоколів, що базуються на патогенетичній фазовості інфекційного процесу [2, 7].
Інвазія SARS-CoV-2 є багатоетапним процесом, що визначає стратегію вибору мішеней для фармакотерапії. Завдяки широкій експресії рецепторів ACE2 у різних органах і системах, SARS-CoV-2 характеризується поліорганним тропізмом [11, 12]. До основних мішеней вірусної інвазії належать:
Критичні форми захворювання асоціюються з деспіральною гіперактивацією імунної системи, що маніфестує у вигляді «цитокінового шторму». Цей стан характеризується неконтрольованою секрецією прозапальних медіаторів (зокрема IL-1β, IL-6, TNF-α), що призводить до розвитку гострого респіраторного дистрес-синдрому (ГРДС), системної ендотеліальної дисфункції та вторинної поліорганної недостатності [2, 12].
Станом на поточний період патоморфологічна картина інфекції зазнала суттєвих змін. Еволюція клінічного патогенезу у 2026 році обумовлена формуванням гібридного імунітету (синергія вакцин-індукованої відповіді та природної імунізації), патологічний процес у більшості випадків лімітується слизовою оболонкою верхніх дихальних шляхів [3, 5, 8]. Проте критично актуальним залишається ризик розвитку постковідного синдрому (Long COVID) [1, 2]. Патогенетичними підґрунтями даного стану вважаються тривала персистенція вірусних антигенів у тканинних резервуарах, порушення мікроциркуляції та ініціація автоімунних каскадів [9, 12].
Сучасна парадигма терапії SARS-CoV-2 диференціюється за стратегічними напрямками, де пріоритетне місце посідає етіотропний вплив [2,6,7].
Застосування препаратів прямої противірусної дії є критично детермінованим на ранній фазі інвазії (перші 72–120 годин), коли вірусне навантаження сягає пікових значень [2, 7]. Основною метою цього етапу є купірування реплікативної активності вірусу та запобігання прогресування хвороби у тяжкі форми [6, 9].
«Золотим стандартом» для пацієнтів із високим прогностичним ризиком госпіталізації залишається інгібітор вірусної протеази — комбінований препарат Паксловід (Нірматрелвір/ Ритонавір) [6, 8].
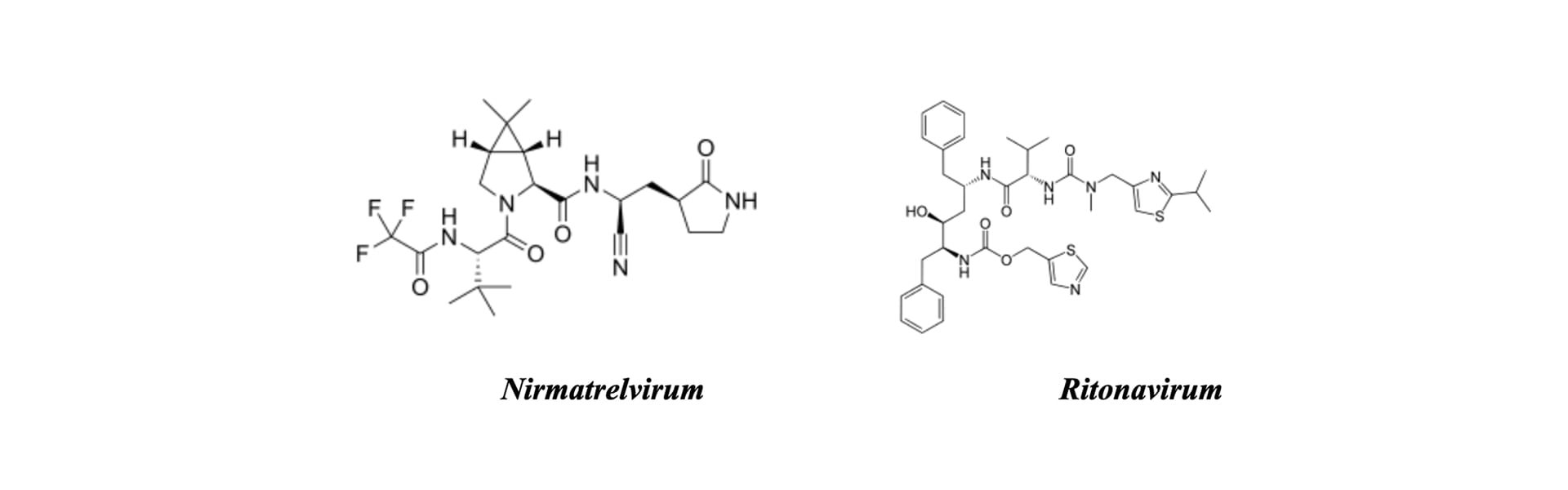
Фармакологічний механізм Нірматрелвіру полягає у селективному інгібуванні головної протеази SARS-CoV-2 (Mpro/3CLpro), що унеможливлює розщеплення вірусних поліпротеїнів та подальшу збірку віріонів. Ритонавір у складі даної комбінації виконує роль фармакокінетичного підсилювача (бустера), пригнічуючи метаболізм Нірматрелвіру через систему цитохрому P450 (CYP3A) [6].
Молнупіравір (нуклеозидний аналог) застосовується як пероральний агент для амбулаторної терапії [2, 6].
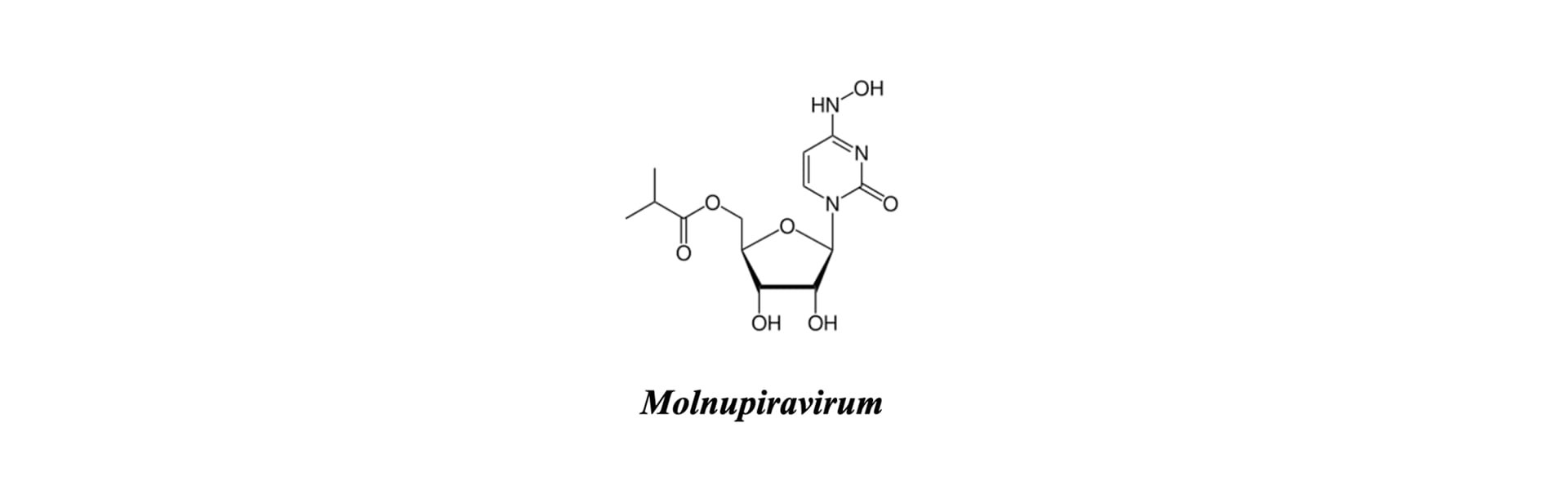
Його механізм дії базується на індукції летального мутагенезу. Препарат включається у ланцюг вірусної РНК замість цитидину або уридину, що призводить до накопичення критичної кількості помилок у геномі та втрати життєздатності вірусних частинок (РНК-мутаген) [8, 10].
Базовим терапевтичним агентом для госпітального сегмента залишається Ремдесивір (нуклеотидний інгібітор РНК-залежної РНК-полімерази (RdRp)) [2, 9].
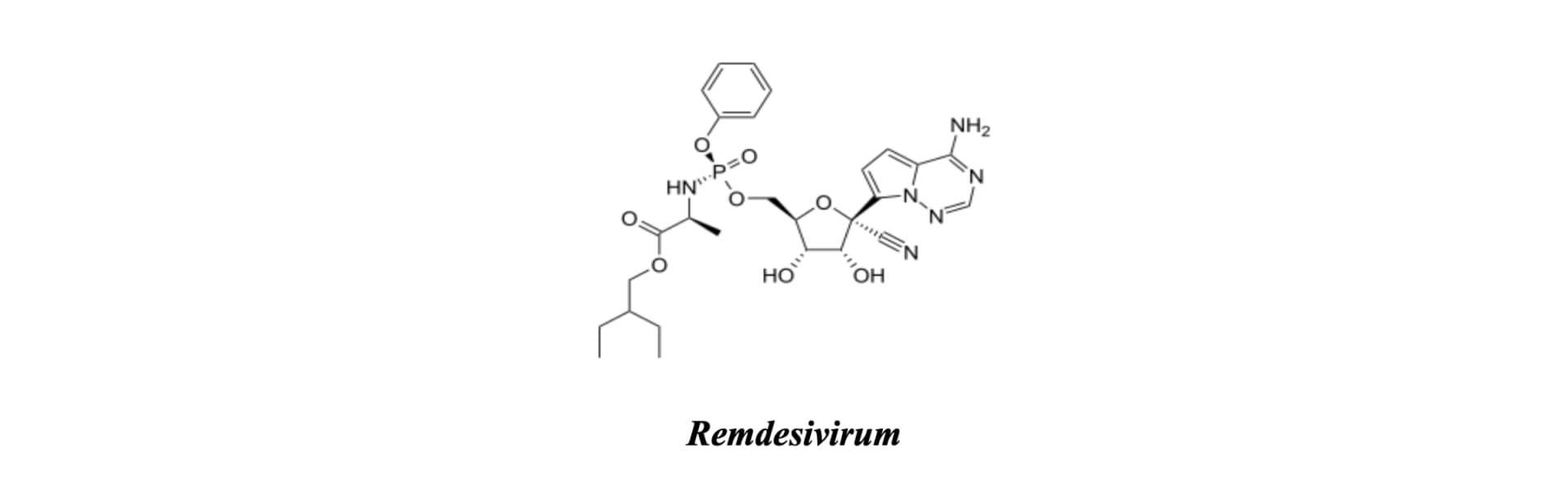
Препарат діє як аналог аденозинтрифосфату, спричиняючи передчасну термінацію синтезу РНК-ланцюга. Згідно з актуальними рекомендаціями ВООЗ, ремдесивір демонструє найвищу ефективність у пацієнтів, які потребують неінвазивної кисневої підтримки [2, 8]. Диференційований вибір препаратів прямої противірусної дії у 2026 році ґрунтується на аналізі коморбідного фону пацієнта та оцінці ризику міжлікарських взаємодій (особливо для препаратів, що метаболізуються через CYP3A4) [6, 7]. Своєчасна ініціація етіотропної терапії дозволяє статистично значущо знизити рівень летальності та частоту розвитку постковідних ускладнень [1, 9].
Патогенетичне лікування базується на прецизійному управлінні імунною відповіддю та системними судинними реакціями. Основний вектор спрямований на деградацію гіперзапального каскаду та профілактику поліорганної дисфункції [2, 12]. Дексаметазон у 2026 році залишається препаратом вибору для пацієнтів, які потребують респіраторної підтримки (оксигенотерапії або ШВЛ) [2, 7].
Згідно з актуальними протоколами 2026 року, застосування системних глюкокортикоїдів суворо регламентоване: їх призначення на ранніх стадіях (до розвитку дихальної недостатності) вважається недоцільним через ризик пролонгації вірусної реплікації [2]. Терапевтичний ефект реалізується через геномні та негеномні механізми пригнічення експресії прозапальних генів [2].
З метою купірування системної гіперзапальної відповіді («цитокінового шторму») застосовуються специфічні блокатори медіаторів запалення антагоністи рецепторів інтерлейкіну-6 (IL-6) [11].
Тоцилізумаб (синтетичний препарат, генно-інженерний імуносупресор) та Сарілумаб (людське моноклональне антитіло до інтерлейкіну-6) верифіковані як ефективні засоби при прогресуючій дихальній недостатності та ознаках системного запалення [8].
Фармакодинамічна активність Тоцилізумабу проявляється у стрімкому зниженні концентрації С-реактивного білка (CRP) та стабілізації альвеолярно-капілярної дифузії [12].
Інгібітори Янус-кіназ (JAK): Барицитиніб та Тофацитиніб інтегровані в протоколи як альтернативні або ад'ювантні засоби, що блокують внутрішньоклітинну передачу сигналів від широкого спектра цитокінів [6, 9].
З огляду на високий ризик розвитку ендотеліїту та асоційованих тромбоемболічних ускладнень, обов'язковим компонентом стаціонарного лікування SARS-CoV-2 є застосування низькомолекулярних гепаринів [11]. Раціональне поєднання імуносупресивної та антикоагулянтної терапії дозволяє мінімізувати ризики розвитку гострого респіраторного дистрес-синдрому та знизити рівень інвалідизації пацієнтів у постковідному періоді [2].
Застосування засобів імунобіологічного захисту у 2026 році зазнало суттєвої ревізії, що зумовлено високою швидкістю антигенного дрейфу SARS-CoV-2 [3]. Еволюція ліній Omicron призвела до значної втрати нейтралізуючої активності більшості ранніх розробок (зокрема комбінації антитіл Казиривімаб / Імдевімаб) [8]. Сучасна стратегія імунобіологічної терапії базується на впровадженні антитіл нового покоління, що таргетують консервативні, малозмінні епітопи S-білка. Пріоритетним напрямком є створення пан-коронавірусних антитіл широкого спектра дії, здатних нівелювати ризики «вислизання» вірусу з-під імунного контролю [12]. Використання препаратів високотитражних антитіл (пасивна імунізація) розглядається як ад’ювантний метод для пацієнтів з імунодефіцитними станами, у яких формування власної імунної відповіді на вакцинацію є недостатнім [7].
Даний напрямок спрямований на стабілізацію фізіологічного статусу пацієнта та мінімізацію суб'єктивних проявів інфекційного процесу [2, 4]:
Застосування анальгетиків-антипіретиків (Парацетамолу, Ібупрофену) регламентується ступенем вираженості гіпертермічного синдрому [2, 4]. В комплексній терапії також доцільною є регідратаційна терапія. Корекція водно-електролітного балансу є обов’язковою для детоксикації та підтримки волемічного статусу. Фармакологічна корекція кашльового рефлексу та застосування мукоактивних агентів підбираються індивідуально, залежно від характеру ураження бронхолегеневої системи [2].
Станом на 2026 рік терапія Long COVID виокремилася у самостійний напрямок. В її основі лежить корекція системного мікросудинного запалення, оксидативного стресу та нейрофункціональних розладів [1, 11]. Своєчасна корекція ендотеліальної дисфункції та порушень гемостазу запобігає ризику віддалених тромботичних наслідків [11]. У клінічній практиці 2026 року в рамках стратегії антитромботичного супроводу широко застосовуються парентеральні антикоагулянти. Для стаціонарного етапу та профілактики тромбоемболічних ускладнень залишається пріоритетним застосування низькомолекулярних гепаринів, зокрема, Еноксапарину [8, 11].
З метою відновлення бар'єрної функції судинного ендотелію застосовуються ангіопротектори та донатори оксиду азоту, переважно препарати L-аргініну, які сприяють вазодилатації та покращують реологічні властивості крові [11, 12].
Застосування L-аргініну як субстрату для ендотеліальної NO-синтази є патогенетично обґрунтованим для відновлення вазодилатаційної здатності судин. Підвищення біодоступності оксиду азоту (NO) сприяє покращенню мікроциркуляції, зниженню адгезії тромбоцитів та відновленню еластичності судинної стінки [11].
Неврологічні прояви Long COVID (когнітивні розлади, порушення пам'яті, депресивні стани) патогенетично пов'язані з церебральним мікроциркуляторним руслом та нейрозапаленням [1, 10].
Фармакотерапевтичний комплекс корекції когнітивного дефіциту включає препарати:
Цитиколін (ноотропна та нейрометаболічна дія). Виступає як донор холіну та попередник фосфоліпідів мембран нейронів. Препарат стимулює біосинтез структурних фосфоліпідів, відновлює активність Na+/K+-насосів та сприяє регресу когнітивного дефіциту [10].
Стандартизовані екстракти Ginkgo biloba (EGb 761) застосовуються як ангіопротектори та антиоксиданти. Вони інгібують пероксидне окиснення ліпідів, покращують церебральну перфузію та нейропластичність [10]. Нейротропні комплекси вітамінів групи B (B1, B6, B12) виконують роль коферментів у метаболічних циклах ЦНС, сприяють регенерації мієлінових оболонок нервових волокон та нівелюванню симптомів астенізації [1].
Згідно з актуальними на 2026 рік протоколами World Health Organization, важливим аспектом реабілітації є адаптогенна підтримка та стимуляція нейропластичності [1]. Застосування метаболічних коректорів та адаптогенів дозволяє подолати хронічний астенічний синдром, покращуючи адаптаційний потенціал організму в постковідному періоді [2].
Комплексний підхід до лікування Long COVID базується на синергії судинної та нейротропної терапії [12]. Це дозволяє не лише купірувати поточну симптоматику, а й запобігти незворотним структурно-функціональним змінам у критично важливих органах-мішенях [10]. Станом на січень 2026 року успіх терапії COVID-19 забезпечується інтеграцією етіотропних, патогенетичних та симптоматичних засобів у межах персоналізованого підходу. Особлива увага до молекулярних мішеней та динамічного моніторингу циркулюючих штамів дозволяє досягати оптимальних клінічних результатів та знижувати рівень постковідної інвалідизації [6, 9].
У 2026 році пріоритетним вектором постковідної реабілітації стала ліквідація наслідків системного ендотеліїту [11]. Запалення інтими судин та деградація глікокаліксу визнані ключовими детермінантами віддалених серцево-судинних ускладнень, що потребує застосування засобів із вираженими ангіопротекторними властивостями [8, 11].
Використання статинів Аторвастатину та Розувастатину в реабілітаційних схемах базується на їхній здатності стабілізувати ендотелій незалежно від гіполіпідемічної дії [11].
Ефект статинів полягає у пригніченні судинного запалення та оксидативного стресу, що критично важливо для пацієнтів із постковідною ангіопатією [10, 11].
Кверцетин (зокрема у ліпосомальних формах або в комбінації з аскорбіновою кислотою) демонструє здатність знижувати проникність капілярів та інгібувати активність прозапальних ензимів (забезпечує ангіопротекцію та антиоксидантний захист) [12]. Його застосування дозволяє нівелювати ексудативні процеси та зміцнити судинний бар'єр.
Сулодексид (суміш глікозаміногліканів — прямий антикоагулянт натурального походження) відіграє специфічну роль у регенерації захисного шару ендотелію (глікокаліксу) [2, 11]. Це запобігає трансендотеліальній міграції запальних клітин та знижує ризик мікросудинних тромбозів у довгостроковій перспективі.
Зміщення фокусу медичної парадигми у 2025–2026 роках із гострої фази на запобігання поширення Long COVID зумовлене високою частотою інвалідизації через судинні та неврологічні розлади [1, 9]. Дані актуальних клінічних досліджень Clinical Trials.gov та звіти Міністерства охорони здоров'я України підтверджують, що синергічне поєднання ендотеліопротекції та нейроцитопротекції є обов'язковою умовою відновлення працездатності та покращення якості життя пацієнтів [4, 8, 9].
Комплексна підтримка пацієнтів згідно протоколів 2026 року базується на корекції окремих симптомів та підтриманні вітальних функцій:
Антипіретична та детоксикаційна підтримка включає застосування селективних інгібіторів ЦОГ для корекції гіпертермії та проведення парентеральної або пероральної регідратації [2, 4].
Респіраторна фармакотерапія. Застосування мукоактивних агентів та кисневої підтримки є стандартним при ураженні нижніх дихальних шляхів.
Призначення глюкокортикостероїдів. Досліджено терапевтичний потенціал інгаляційних форм стероїдного препарату будесоніду на ранніх етапах інвазії [2, 8].
Попередні дані вказують на здатність стероїдів знижувати інтенсивність місцевого запалення та запобігати госпіталізації, проте їх широка імплементація потребує подальшої верифікації в межах рандомізованих клінічних випробувань [6, 8].
З метою подолання «терапевтичного дефіциту» триває пошук нових фармакологічних мішеней серед уже зареєстрованих препаратів, тобто перепрофілювання лікарських засобів (Drug Repurposing) [8, 9]. Використання такої стратегії дозволяє скоротити час на впровадження ефективних схем ад'ювантної терапії. Досить актуальною є також оптимізація специфічної профілактики, а саме, імплементація оновленого Національного календаря профілактичних щеплень (чинного з 01.01.2026), який гармонізує вітчизняні стандарти з міжнародними вимогами [3, 4]. Вивчення імуногенності сучасних вакцин щодо циркулюючих штамів у сезоні 2025/2026 є критичним для підтримання колективного імунітету [3, 8].
Одним із важливих чинників подолання коронарірусної інфекції є дотримання раціональної антибіотикотерапії з метою запобігання антибіотикорезистентності. Не припустиме рутинне призначення антибактеріальних препаратів при вірусній інвазії без об’єктивної верифікації бактеріальної коінфекції. Станом на 2026 рік у науковій спільноті досягнуто консенсусу щодо недоцільності рутинного призначення антибактеріальних препаратів при COVID-19, зважаючи на вірусну етіологію захворювання [2, 5]. Згідно з актуальними рекомендаціями ВООЗ (Clinical management of COVID-19, 2025), застосування антибіотиків широкого спектра дії (зокрема макролідів, таких як Азитроміцин, та цефалоспоринів III покоління — Цефтріаксон) суворо лімітоване [2, 7].
Фармакотерапевтичне втручання даної групи вважається обґрунтованим лише за умови клінічної або лабораторної верифікації бактеріальної суперінфекції. Раціоналізація використання антимікробних агентів є стратегічним завданням, спрямованим на запобігання поширенню антибіотикорезистентності, що стало глобальним викликом у постпандемічний період [2, 5, 8].
Наразі регуляторна політика фокусується на моніторингу безпеки лікарських засобів та забезпеченні стійкості ланцюгів постачання. Державна програма реімбурсації «Доступні ліки – 2026» відіграє ключову роль у забезпеченні пацієнтів життєво необхідними препаратами в умовах ендемічного поширення SARS-CoV-2 [4, 5, 7].
Сучасний вектор подальших фармацевтичних розробок спрямований на подолання антигенної мінливості SARS-CoV-2 та створення універсальних противірусних платформ. Основними перспективними напрямками станом на 2026 рік є:
Комплексний аналіз фармакотерапевтичних призначень станом на початок 2026 року свідчить про глибоку трансформацію підходів до лікування COVID-19. Перехід від екстреної симптоматичної допомоги до патогенетично обґрунтованого менеджменту, що включає ендотеліопротекцію та нейроцитопротекцію, дозволив суттєво знизити тягар постковідних ускладнень [1, 10]. Подальший прогрес галузі пов’язаний із впровадженням інноваційних молекулярно-генетичних методів лікування та підтримкою високого рівня імунного захисту популяції через адаптивну вакцинацію [3, 7].
Сучасна стратегія фармакотерапії COVID-19 демонструє високу динамічність, що зумовлено безперервною еволюцією антигенних властивостей SARS-CoV-2. Станом на початок 2026 року відбулася остаточна трансформація протоколів лікування: від емпіричних схем екстреного реагування до персоналізованих алгоритмів, що базуються на молекулярно-генетичному моніторингу циркулюючих штамів [1, 5, 8].
Попри зниження чутливості окремих терапевтичних агентів (зокрема моноклональних антитіл першої генерації) до нових варіантів вірусу, найбільш раціональним залишається мультимодальний підхід [2, 7]. Синергічне поєднання етіотропних препаратів прямої противірусної дії, селективних імуномодуляторів та засобів патогенетичної корекції ендотеліальної дисфункції забезпечує оптимальний клінічний прогноз та знижує ризик прогресування інфекції [6, 11, 12].
Ключовим вектором подальших досліджень має стати проведення масштабних рандомізованих клінічних випробувань для верифікації довгострокової безпеки та ефективності новітніх засобів (інгібіторів JAK, РНК-інтерференції), а також оптимізація схем реабілітації пацієнтів із постковідним синдромом [9, 10]. Пріоритетним завданням для фармацевтичної галузі залишається розробка універсальних терапевтичних платформ, здатних забезпечити стійку відповідь на майбутні виклики вірусної мінливості [3, 8].